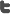FDA ha aprobado 19 productos biosimilares en los últimos 4 años. EMA 58 en los últimos 11.
La FDA en los últimos 4 años ha aprobado 19 Biosimilares, así lo ha constatado el análisis realizado por nuestra ONG a partir de la Base de Datos de la misma FDA (purple book). De acuerdo a la normativa vigente sanitaria en Chile los Medicamentos Biosimilares son medicamentos Biotecnológicos que han demostrado tener atributos de calidad, seguridad, eficacia e inmunogenicidad, similar a un medicamento Biotecnológico reconocido como referente, para lo cual deben ingresar un dossier completo de calidad, más el estudio de comparabilidad de los antecedentes de calidad, estudios pre-clínicos, estudios clínicos y de inmunogenicidad, que correspondan. (Decreto exento 945/2014 que aprueba Norma N° 170) La importancia de este hecho radica en que la aprobación de productos biosimilares puede mejorar el acceso a las terapias biológicas para los países y los pacientes aumentando la cantidad de opciones de medicamentos que potencialmente pueden ser de menor costo. Por otro lado, en la mayoría de los países Europeos donde predominan los esquemas de acceso a medicamentos basados en Sistemas de Precios...
Read More