Investigación clínica de fármacos en Chile: Una reflexión necesaria.
….
Por Rodrigo López M. y equipo CEPFAR.
Dentro del mundo de los profesionales de la salud existe una sensación ambiental acerca de la investigación clínica como emergente “campo laboral” para enfermeras, médicos y químicos farmacéuticos. La realidad indica que en efecto los ensayos clínicos van en aumento en Sudamérica, y en los países en desarrollo en general, por tanto es necesario reflexionar respecto a esta disciplina y su aporte actual en nuestro país en términos científicos, salubristas, económicos y laborales.
Radiografía de los ensayos Clínicos: ¿Quienes hacen pruebas de fármacos en Chile?
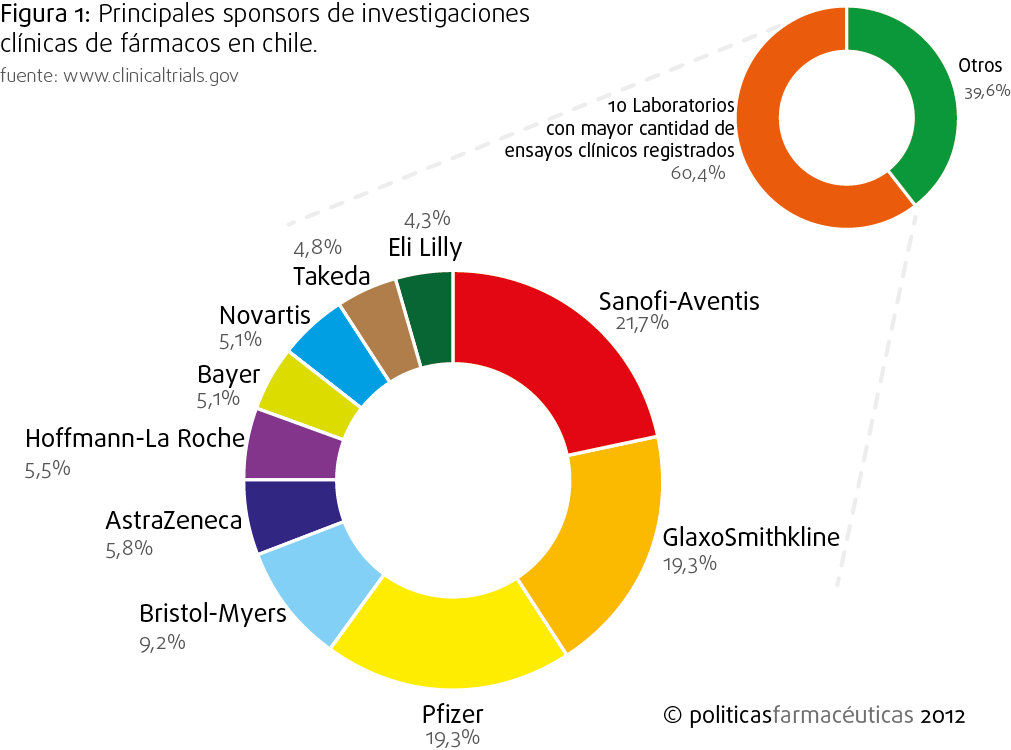
Decidimos hacer una búsqueda en la principal base de datos mundial sobre ensayos clínicos: www.clinicaltrials.gov, la cual entrega información detallada sobre la información clínica y administrativa de los ensayos que se realizan en cualquier parte del globo, independiente del país al cual pertenezca la institución solicitante y de las características del ensayo y las intervenciones involucradas (fármacos, biológicos, dispositivos médicos o conductuales). Según clinicaltrials.gov, en este momento se llevan a cabo 687 ensayos clínicos en Chile entre fármacos y productos biológicos (considerando ensayos en reclutamiento, intervención y estudios ya completados, en etapa de análisis)*. Los principales sponsors de estos estudios (esto quiere decir, quienes financian los ensayos), son laboratorios con residencia en el extranjero, de hecho, el 70% de los estudios clínicos está concentrado en sólo 10 laboratorios multinacionales, según lo indica la Figura 1. La lista la lideran tres gigantes de la BigPharma: Sanofi-Aventis (Francia), GlaxoSmithkline (UK) y Pfizer (USA). Un dato interesante es que, según el estudio 2012 de Evaluate Pharma, se estima que estas farmacéuticas serán las compañías número 3, 4 y 2, respectivamente, en venta de fármacos de prescripción para el año 2018**.
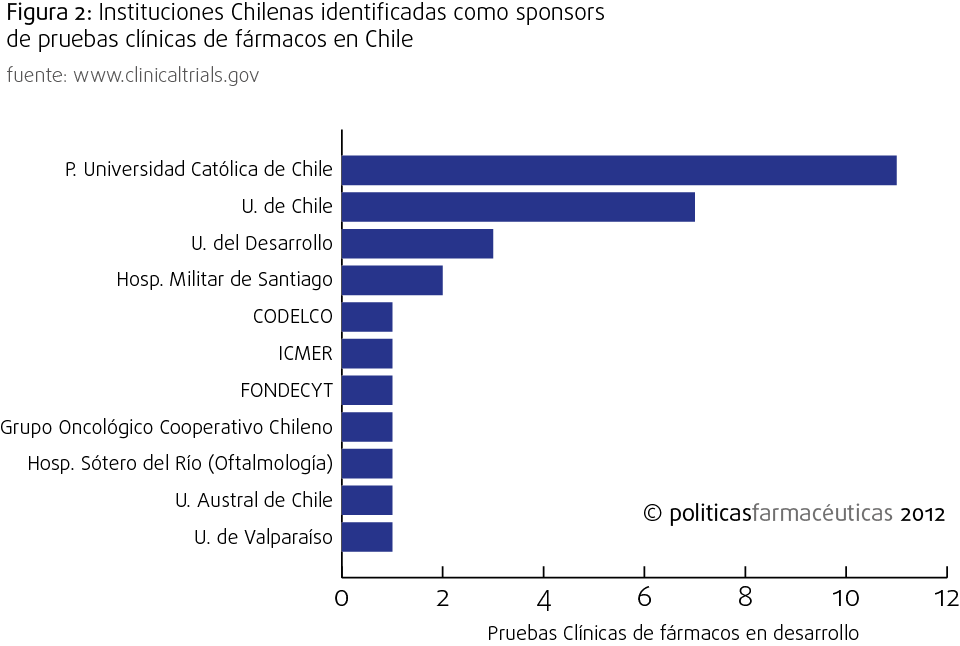
Respecto a participación de iniciativas nacionales en estudios clínicos, los sponsors nacionales ocupan sólo un 4,4% de los registros de pruebas clínicas, dentro de los cuales la Pontificia Universidad Católica es la principal institución con 11 ensayos. Lo más importante, no obstante, es la absoluta ausencia de laboratorios farmacéuticos nacionales. Este fenómeno no es de exclusividad de la industria farmacéutica, ya que como veremos más adelante, Chile se destaca por ser uno de los países con más baja inversión en investigación y desarrollo de la OCDE (el promedio de la OCDE es de 2,4%, mientras que Chile gasta aprox. 0,4 del PIB), lo que relega a la industria nacional a un rol de imitación de tecnología e innovación proveniente el hemisferio norte.
La externalización de servicios o outsourcing es una estrategia de maximización de recursos aplicada en diversos sectores, ejemplo clásico son los call-centers y los servicios de programación de software. La realización de pruebas clínicas no ha quedado exenta de esta estrategia. Desde hace un tiempo, los ensayos están siendo externalizados por los laboratorios, entregando el proceso de prueba a un tercero, que se denomina contract research organization (CRO), estas empresas se hacen cargo de la etapa de “desarrollo” del fármaco, fundamentalmente de los estudios donde se busca evaluar la eficacia del fármaco (también llamados estudios de fase II y fase III). El negocio pareciera ser bueno, de forma tal que existen empresas que ya se han posicionado como las CROs más importantes del mundo, como es el caso de Quintiles, Parexel, Covance y Pharmaceutical Product Development, todas con presencia en Chile. Inclusive existen CRO especializadas por regiones, como es el caso de ReSolutions Latin Amética, quien promociona las ventajas de Latinoamérica para hacer ensayos clínicos por tener “Grandes poblaciones de paciente (relativamente treatment naive***) concentradas en áreas urbanas” o simplemente tener “menores costos para conducir pruebas”.
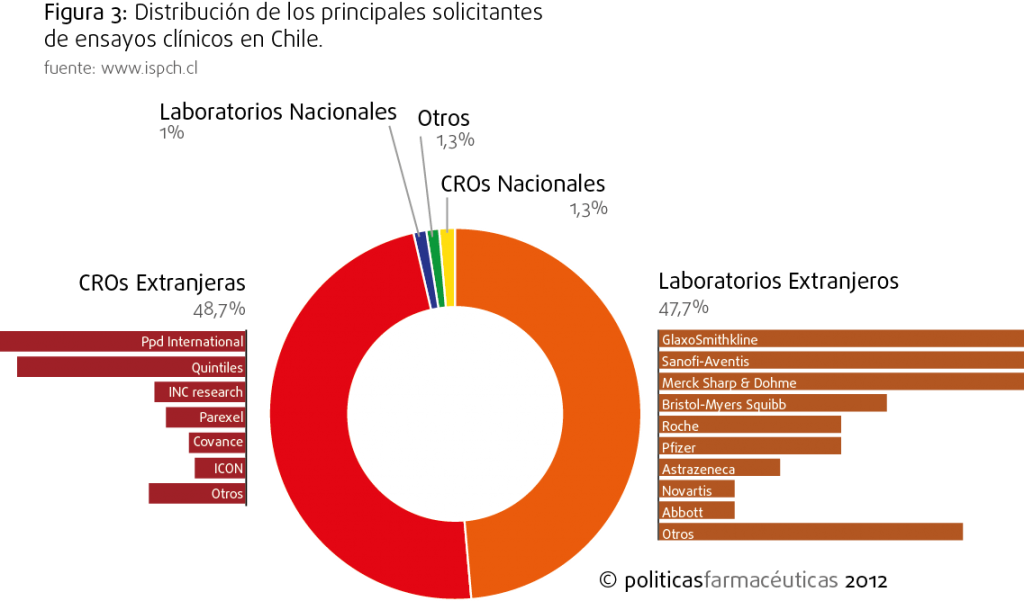
En Chile, quien ejecuta y supervisa el ensayo es denominado solicitante ante el ISP. En la base de datos de clinicaltrials.gov la información de solicitantes no es indicada, por tanto recurrimos a la base de datos de ensayos clínicos registrados en el ISP para obtener dicha información. Debemos consignar que la base de datos del ISP, de libre acceso, difiere en la cantidad de ensayos registrados respecto a la lista obtenida en clinicaltrials.gov (306 estudios registrados en el ISP, versus 687 obtenidos de clinicaltrial.gov). Es interesante también destacar que la base de datos de ISP se limita a hacer un seguimiento del cumplimiento de la normativa legal que requiere cada estudio (inscripciones de centros, bodegas y otros procesos involucrados en el estudio clínico), mientras que clinicaltrials.gov entrega información detallada de intervenciones, diseño experimental, género y parámetros de evaluación clínica (outcomes). No obstante, la información sobre los solicitantes se puede obtener sólo en www.ispch.cl.
En la figura 3 se muestra un detalle de la los solicitantes de pruebas clínicas en Chile. En este punto nos encontramos que hay dos grandes tipos de solicitantes: Laboratorios internacionales que ejecutan sus propios estudios (47,7%) y CROs Internacionales (48,7%). Este análisis se hace relevante, dado que, desde un punto de vista laboral, el campo de la investigación clínica podría generar un polo de emprendimiento. Podríamos hacer el ejercicio de visualizar la disponibilidad de pacientes como un recurso, mirándolo bajo esa arista, el mejor aprovechameinto de este recuso, para beneficio de la sociedad, sería que fuera explotado por empresas nacionales, por tanto un escenario ideal de desarrollo y de aprovechamiento del recurso implicaría una activa participación y ebullición de empresas CRO nacionales. No obstante, la situación de las CRO nacionales es bastante incipiente y su participación actual en el sistema de ensayos clínicos es menor. En la actualidad existe registrada sólo una CRO Nacional (Dr. Mix Consultant In Research & Operations Limitada) quien figura en la lista con sólo 2 estudios en ejecución. Por tanto a simple vista parece que sencillamente se está limitando a ocupar los centros clínicos y sus profesionales como lugares de ejecución y mano de obra, sin participación mayor sobre el análisis de la información, o sea, se replica el modelo de explotación y de inversión que observamos en otros campos industriales, es necesario entonces encontrar dónde esta la ganancia para Chile de esta investigación clínica.
Es importante destacar, de todas maneras, que el modelo de las CRO es interesante, dado que son empresas especializadas en la experiencia clínica que carecen en todo sentido los investigadores básicos, por tanto una potenciación de este tipo de empresas a nivel nacional podría generar un escenario favorable para la formación de alianzas estratégicas en la que mucha de la investigación básica en terapéutica vea luz en aplicaciones clínicas reales, sin necesidad de tener que vender una patente para que su desarrollo sea hecho por laboratorios extranjeros, que además no necesariamente están interesados en el desarrollo de investigación básica nacional.
.
¿Son los estudios clínicos un indicador de avance científico-tecnológico en medicina?
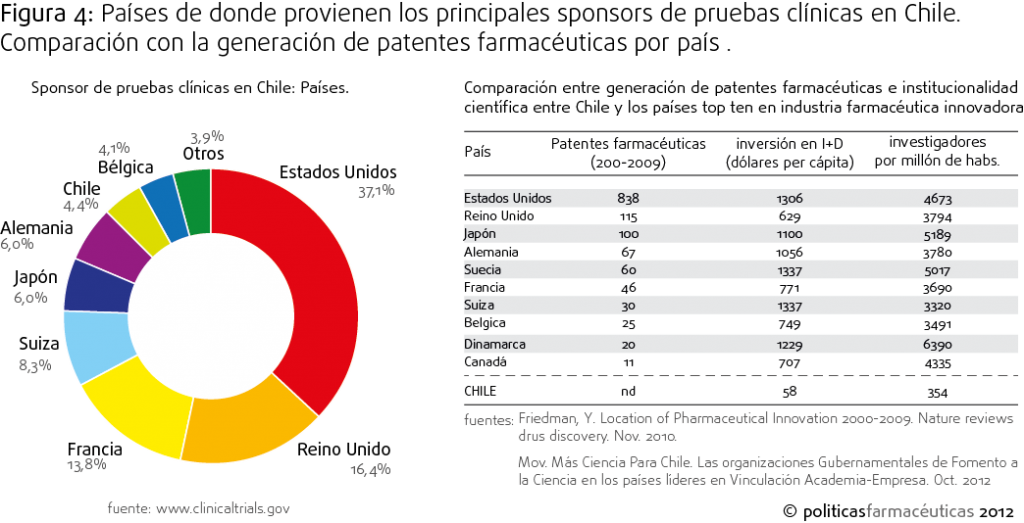
Cuando se analiza la proveniencia por países de los laboratorios que realizan estudios clínicos en Chile nos encontramos un escenario totalmente predecible: los países con mayor presencia en ensayos clínicos en Chile coinciden con los países que tienen mayor generación de patentes farmacéuticas (Figura 4). Por tanto, es posible pensar que la información que se genera en los pacientes chilenos termina principalmente siendo ocupada para la explotación de una patente de un laboratorio extranjero.
El tema de las patentes no es un tema menor, porque el marco conceptual de la ciencia en Chile está virando hacia la llamada “ciencia aplicada”, donde la generación de patentes es el parámetro dorado de la aplicabilidad de la investigación****. Sin embargo, la fortaleza de los países líderes en innovación farmacéutica se asienta en su capacidad basal de investigación y desarrollo, donde la diferencia con Chile es francamente abrumadora. De hecho los países top ten en innovación farmacéutica están al menos entre los primeros 20 países más importantes en la generación de patentes a nivel mundial, lo cual va de la mano con niveles de gasto en I+D y generación de capital humano científico al menos 10 veces más grande que el Chileno. (Figura 4).
Caso interesante, y digno de imitar es el de Japón, el cual sin tener una “tradición farmacéutica”, como E.E.U.U., Reino Unido, Francia o Suiza, ha logrado posicionarse como el tercer país en patentes farmacéuticas, y el segundo país generador de patentes considerando todos los ámbitos de desarrollo, lo cual se relaciona directamente con su alto nivel de gasto en I+D y con la altísima proporción de investigadores per cápita.
.
.
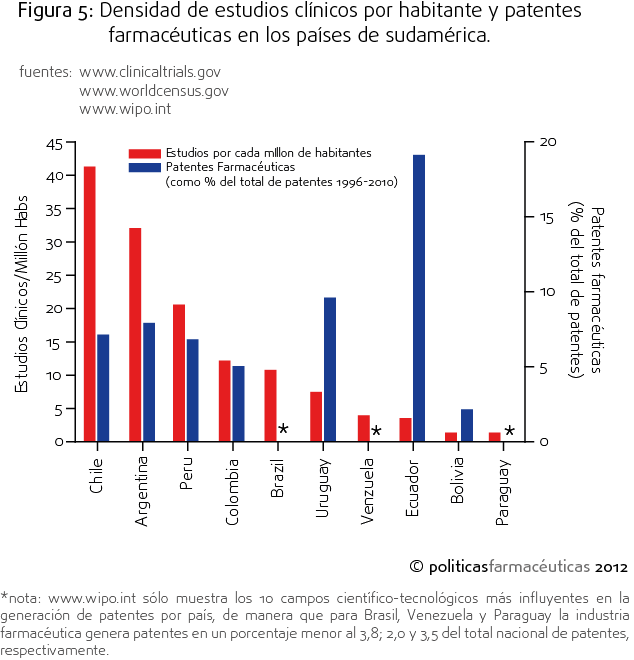
Trayendo la discusión a nivel latinoamericano, vemos que Chile es el primer país de latinoamérica en ensayos clínicos per cápita (Figura 5), eso podría ser un dato optimista en términos de la importancia que puede tener la investigación farmacéutica respecto la región. Sin embargo, esta aparente ventaja de tener una gran cantidad de estudios no se refleja en un grado predominante de la investigación farmacéutica, dado que el número de patentes generadas en Chile no es proporcionalmente superior al resto de los países latinoamericanos.
.
.
El equilibrio entre desarrollo y acceso a nuevas medicinas.
La triada ensayos-patentes-acceso es muy importante a tener en cuenta. Ya mencionábamos que la mayoría de los ensayos clínicos hechos en Chile generan información que es ocupada por un laboratorio extranjero que ya tiene patentado el tratamiento en estudio. Si el producto resulta ser efectivo (al menos lo suficientemente efectivo como para obtener un registro sanitario), se procede a su comercialización protegida por patente, en donde laboratorio se posiciona en una situación monopólica-dominante que es protegida legalmente, teniendo como justificación el retorno de la inversión de I+D (es interesante también pensar cómo las patentes han pasado de ser una protección a la invención en una protección a la inversión). Por tanto es necesario también pensar sobre el beneficio que se obtiene a partir del ensayo en humanos y si realmente existe un equilibrio en la distribución del beneficio entre sponsor-voluntarios-sociedad.
La declaración de Helsinki, el código de ética mundial para la investigación en humanos, dice en su artículo N°33: «Al final de la investigación, todos los pacientes que participan en el estudio tienen derecho a ser informados sobre sus resultados y compartir cualquier beneficio, por ejemplo, acceso a intervenciones identificadas como beneficiosas en el estudio o a otra atención apropiada o beneficios», lo que implica que todos los participantes debieran tener acceso al beneficio, o sea el tratamiento, que se ha generado con esa investigación. Pero, ¿quiénes son los participantes?, si bien parece una pregunta retórica (y lo es), queremos llevar llevar la discusión hacia un punto claro: que tras la participación voluntaria de un individuo existe un sistema de salud y una sociedad, que a través de su estructura, permite la entrada de los interesados en hacer estudios y la correcta realización de éstos. El hecho que haya proporcionalmente más estudios en Chile que en otros países de Sudamérica (Figura 5) probablemente no responde a un tema de costos (claramente debiera ser más barato hacer estudios en Bolivia o Paraguay), sino que pasa por la factibilidad técnica, la burocracia y la estructura de salud que permiten que estos estudios se realicen de buena manera, con datos confiables, de manera que la dualidad entre las faltas de regulación y la elevada calidad de los profesionales involucrados en los estudios hace que sea costo-beneficioso hacer un estudio en nuestros centros. Y eso nos lleva a la reflexión con que iniciamos este artículo ¿se ha dado cuenta cuantos profesionales de la salud trabajan en estudios clínicos?, ciertamente son muchos, y por tanto la formación de capital humano clínico encuentra un nuevo nicho, alejando el ejercicio de su foco principal: el cuidado de la salud, y llevándolo hacia la prestación de un servicio de “medición de parámetros” para un tercero que saca provecho científico y económico de este conocimiento, un ejemplo de esto, es la deficiencia de médicos y fundamentalmente especialistas en el sistema público de salud.
Una consideración final: Acceso abierto abierto a la información de pruebas clínicas.
A partir de la polémica derivada de los datos clínicos del producto Tamiflú (Laboratorio Roche), prestigiosas revistas del ámbito de la medicina, principalmente el British Medical Journal, han abierto la discusión respecto a la disponibilidad y publicación de los datos derivados de pruebas clínicas (recomendamos fuertemente ver la campaña BMJ open data). La discusión se centra en el destino final de la información extraída de la experimentación en humanos.
Para dar más claridad respecto este punto es necesario explicar el intervalo que pasa después de la prueba clínica: una vez que el ensayo de un fármaco en humanos ha concluido, hay tres alternativas, que el fármaco sea más efectivo que los tratamientos actuales (si los hubiere), que sea igual de efectivo que el tratamiento actual (o el placebo), o que sea menos efectivo (o incluso perjudicial). Si el resultado corresponde al primer caso, claramente será publicado en las mejores revistas del área médica y su anuncio se hará con una fanfarria de marketing espectacular. Si fuera el segundo caso, probablemente sus resultados serán reportados de manera más discreta (congresos científicos y charlas de expertos pagados por la compañía farmacéutica). Pero el caso que riñe directamente con la ética es el tercero: si el tratamiento es inefectivo o perjudicial la información no se publica y, francamente, se esconde. Lo que implica que se sometió a seres humanos a un experimento cuyo resultado no será contribución ni siquiera al conocimiento (ya que nadie lo sabrá). Peor aún, al desconocer esa información, puede que se repita el algún lugar del mundo ese ensayo, exponiendo apacientes a una prueba ya hecha, y por tanto innecesaria, lo cual contradice cualquier código ético de investigación. Caso más complejo es cuando de un mismo fármaco se obtienen pruebas positivas y negativas en diferentes centros, donde se publican solamente las positivas y las negativas pasan al olvido, generando un falso resultado de eficacia producido por el tratamiento estudiado*****.
La discusión que lidera el BMJ apremia al EMA (Agencia reguladora de medicinas de Europa) a que se obligue a cada sponsor de ensayos clínicos a publicar toda la información resultante de un estudio clínico (ya sea positiva o negativa), de manera de asegurar que el acto altruista de participar como voluntario sea al menos recompensado en generar información útil y disponible para el beneficio de la humanidad.
Una estrategia planteada por el Médico británico Ben Goldacre es establecer a nivel a nivel de Agencias Reguladoras y Comités de Ética la estricta obligación de divulgar los ensayos clínicos a más tardar un año de terminada la prueba clínica, como requisito de aceptación del ensayo. La legislación que regula la ejecución de estudios clínicos en Chile (Norma Técnica N°57/2001 y Ley 20.120/2006) no contemplan en ninguno de sus puntos la obligatoriedad de divulgación de estos resultados. Por otra parte, dada que la tutela ética de los estudios queda en manos de comités ético-científicos no centralizados, para rastrear si los comités de ética establecen este punto, habría que revisar si cada comité tiene como requisito esta obligatoriedad de publicación.
No cabe duda que Chile es una muestra pequeña de lo que pasa en los estudios clínicos en el mundo, pero no por eso debiéramos conformarnos con ser una replica a pequeña escala respecto a la investigación clínica mundial. El tema a reflexionar no es la influencia de Chile en la industria farmacéutica, sino que cómo potenciamos la generación y consolidación del conocimiento dentro de nuestro territorio (sin necesariamente prohibir o desincentivar el ingreso de extranjeros) y cómo la normativa de estudios asegura que la información obtenida de paciente Chileno aporta más allá de llevar dividendos a una industria avecindada fuera de nuestras fronteras, al final del día, el beneficio mayor que debemos buscar por sobre todo es el de nuestra población, tanto a través del acceso a nuevas medicinas, como también a través de la externalidad positiva a nivel social que genera el desarrollo científico.
NOTAS:
* Para el análisis de ensayos clínicos contenidos en este artículo se utilizó la base de datos de www.clinicaltrials.gov. Se realizó una búsqueda avanzada de todos los ensayos que contenían en el campo de “intervención” los términos “drug” o “biological”, descartando de esta manera aquellos ensayos clínicos de dispositivos clínicos u otro tipo de intervenciones. Además se excluyeron aquellos estudios con estatus “desconocido”, eso quiere decir, aquellos estudios sin actualización de estado hace más de dos años. Toda la información fue recopilada el 14 de Noviembre del 2012.
** Según evaluaciones de EvaluatePharma 2018, las 5 compañías que más venderán fármacos de prescripción el 2018 serán: Novartis, Pfizer, Sanofi, Glaxo y Roche. www.evaluatepharma.com
*** El término “treatment naive” es complicado de traducir, pero se podría describir como un paciente que no ha recibido tratamiento previo, lo cual es ideal en una situación de experimentación clínica, ya que no habría otra condición más que la patología y la intervención experimental (tratamiento) a la cual se sometería el paciente. Esto genera una complicación ética, dado que deber de un estado es proporcionar un nivel de salud básico, y no permitir que otros aprovechen esa condición para generar un escenario de experimentación ideal.
**** En este contexto, la reciente intención de cambiar la locación de CONICYT desde el ministerio de Educación al ministerio de Economía podría tener profundas repercusiones a la visión-país respecto a la utilidad de la ciencia en el modelo de desarrollo. Para más análisis sobre el debate de la institucioanlidad científica en Chile recomendamos revisar el sitio de la organización “más ciencia para Chile” www.mascienciaparachile.cl
***** La manipulación en la presentación de resultados de pruebas clínicas está altamente documentado, algunos ejemplos se pueden encontrar en: Dwan K (PLoS ONE, 2008) y Smyth R (BMJ, 2011)


Me pareció muy interesante el articulo
Quisiera información acerca de los centros de estudios clínicos activos en Chile. Soy médico extranjero con experiencia en ensayos y quisiera contactarme.