Bioequivalencia: ¿Fracaso de una política pública?.
El nuevo escenario a raíz del dictamen de la Contraloría General de la República, que deja sin efecto la Resolución 244/11 que establece la fecha de vigencia para la exigencia de estudios de bioequivalencia, viene a «coronar» un proceso que ha sido largo y dificultoso en su implementación, y que además ha sido objeto de fuertes presiones desde la industria farmacéutica de similares y genéricos.
Este 2012 se inició con concurridas conferencias de prensa en el ISP (Instituto de Salud Pública de Chile), en la primera se anunció que Chile ya contaba con 54 medicamentos bioequivalentes y, posteriormente, en conjunto con el Ministro de Salud Jaime Mañalich, se presentó el nuevo logo identificatorio de éstos productos. En palabras de la autoridad se dio :» …un paso más al instruir por decreto a la industria farmacéutica de que los fármacos, los medicamentos que tengan Bioequivalencia certificada y demostrada…»
Sin embargo, la alegría escondía indicadores poco alentadores, como se demostró en un análisis elaborado por nosotros, solo un 9 % del total de medicamentos que debían cumplir con la norma fueron certificados como equivalentes terapéuticos. Es decir, después de 7 años desde que se publicó la primera norma de bioequivalencia en Chile, el resultado objetivo es que de 412 medicamentos que debían cumplir, sólo 36 cumplieron la exigencia. Un fracaso evidente.
Pero a diferencia de otras administraciones, el Ministerio de Salud, frente al incumplimiento por parte de la industria farmacéutica, decidió hacer uso de sus atribuciones y cursó los sumarios correspondientes a los laboratorios que no cumplieron, en total más de 120 sumarios sanitarios con multas individuales cercanas a las 1.000 UTM (casi 40 millones de pesos).
LABORATORIO RECALCINE Y SU RECLAMO EN LA CONTRALORIA GENERAL DE LA REPÚBLICA.
La Corporación Farmacéutica Recalcine (CFR) , reconocido laboratorio nacional que ha desarrollado un notable crecimiento regional e internacional liderado por Alejandro Weinstein, interpuso a través de su abogado Gabriel Zaliasnik, un requerimiento en la Contraloría General de la República solicitando un pronunciamiento acerca de la «juridicidad» de la resolución exenta N° 244. Un requerimiento dirigido netamente sobre la forma que sobre el fondo de la resolución.
Vale la pena mencionar que durante el mes de Febrero de 2012, el ISP realizó diversos sumarios sanitarios a CFR, por el no cumplimiento de la obligación de acreditar equivalencia terapéutica, dichos sumarios suman multas que superan las 3.000 UTM.
El dictamen 25166 de la Contraloria (con fecha 02-05-2012 y disponible en www.contraloría.cl) fue contundente: declaró que desde la entrada en vigor del decreto N° 3 (Reglamento de sistema Nacional de productos farmacéuticos) , las disposiciones y demás procedimientos para la realización de los estudios de equivalencia terapéutica deben establecerse mediante decreto supremo del Ministerio de Salud y no a través de resoluciones exentas del ISP. Lo que en la práctica implica, que tanto los plazos establecidos para cumplir con la certificación de la equivalencia terapéutica, como además los sumarios instruidos a la industria farmacéutica son legalmente inválidos.
BIOEQUIVALENCIA SIN GMP, LAS PARTICULARIDADES DE NUESTRO SISTEMA
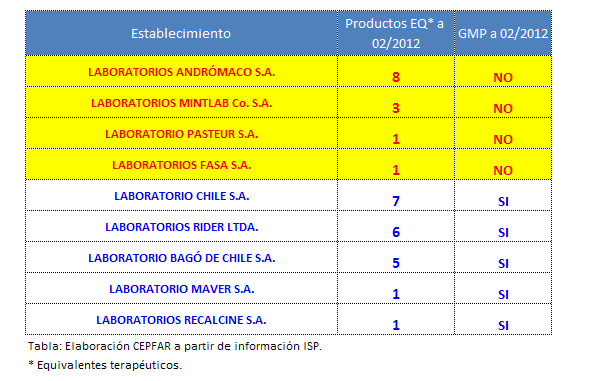
Aparentemente, no todos los problemas relacionados a la implementación de la bioequivalencia son de tipo jurídico-administrativos. Existe otro elemento que llama la atención y da para reflexionar, dado que no se ha establecido como requisito de los laboratorios para la validación de equivalencia terapéutica, el contar con la certificación GMP. Esto genera un escenario cuasi kafkiano, en donde un laboratorio que no cumple con las GMP puede obtener la certificación de equivalencia terapéutica, a todas luces esto representa una incongruencia.
Información disponible públicamente a través del ISP, y mostrada en la tabla a continuación, nos permite apreciar algunos laboratorios que han logrado certificar equivalencia terapéutica, sin contar con la certificación de Buenas prácticas de manufactura (GMP):
EL FRACASO DE UNA POLÍTICA PÚBLICA.
Las políticas públicas establecen los cursos de acción para abordar diversas problemáticas sociales, valiéndose de intenciones e instrumentos. En este acaso, la problemática es clara, y esta referida al uso de la equivalencia terapéutica como forma de certificar que los productos farmacéuticos de múltiples fuentes (medicamentos similares y genéricos), cumplen con los mismos estándares de calidad, eficacia y seguridad que el producto de referencia (generalmente un innovador).
Esta certificación es un avance significativo para asegurar que los medicamentos a los cuales accede la población, pese a presentar diferencias en cuanto a fabricante y precio pueden ser intercambiables, lo que reviste una gran importancia en un mercado donde abundan los medicamentos similares, los incentivos a la prescripción, las asimetrías de información y otros elementos distorsionantes en la relación fármaco-paciente.
Sin embargo, se presentan grandes fallos desde el punto de vista de la implementación, ejecución y evaluación de esta necesaria política pública, lo que ha sido transversal a los últimos gobiernos y que nos debe llamar a la profunda reflexión. Se suma a esto, las históricas presiones que ha debido enfrentar el Estado, que provienen de un sector poderoso en cuanto a influencias y recursos.
Sin duda que estamos frente a una situación preocupante, que da cuenta de un sistema con fallas estructurales no tan sólo en el ambito público, sino que también en el ámbito privado, lo que se hace insostenible para un país OCDE que pretende alcanzar el » desarrollo» al fin de ésta década.
Es urgente, revisar y reimpulsar enérgicamente esta política pública y para aquello se necesita tanto la seriedad al momento de generar los instrumentos adecuados, como además de la cooperación privada , para así evitar que la influencia del lobby y los procesos judiciales dilatorios sigan manteniendo un manto de duda sobre la calidad y la eficacia de los medicamentos en Chile.
Conoce aquí la resolución 025166N12 de la Contraloría General de la República